Exercice III :
On mélange 100 mL de solution de permanganate de concentration
1.10
-2 mol.L
-1 avec 250 mL de solution de Nitrate
de fer II de
concentration 3.10
-2 mol.L
-1et 10 mL d'acide
sulfurique concentré (les ions H
+ sont en excès) .
Les ions permangante réagissent avec les ions fer II . L'équation de la
transformation est la suivante : MnO
4- + 5Fe
2+
+ 8H
+ 
= Mn
2+
+ 5Fe
3+ + 4H
2O
.
Les ions permangante donnent une couleur violette à la solution .
Une solution contenant des ions fer III est jaune .
Les autres ions peuvent être considérés comme incolores .
Déterminer la couleur de la solution obtenue après le mélange .
Exercice IV :
On réalise le dosage d'une solution de peroxyde d'hydrogène (eau
oxygénée) H
2O
2 notée S
1
par une solution acidifiée de
permanganate de potassium notée S
2 . La réaction
support de ce dosage est :
2MnO
4- + 5H
2O
2 + 6H
+
= 2Mn
2+ + 5O
2 + 8H
2O
La manipulation est la suivante :
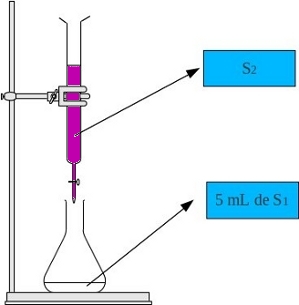
La concentration de la solution S
2 est C
2 = 1,0.10
-2
mol.L
-1 .
Le volume versée à l'équivalence est Véq = 15 mL .
L'acide est en excès .
1- Quel est la nature du dégagement gazeux lors de l'ajout du
permanganate sur l'eau oxygénée ?
2- Comment visualise-t-on l'équivalence ?
3- Dresser un tableau d'avancement à l'équivalence .
4- Déterminer la concentration en H
2O
2 de la
solution d'eau oxygénée .
Exercice V :
On brûle 3 g de fer dans un flacon de 2L rempli de dioxygène . Il se
forme exclusivement de l'oxyde de fer Fe
3O
4 .
1- Ecrire et l'équilibrer l'équation de la réaction
2- Déterminer les quantités de matière des réactifs
3- Dresser un tableau d'avancement
Quel est le réactif limitant ?
Quelle quantité de matière d'oxyde de fer va t-on
obtenir ?
Quelle masse d'oxyde de fer va t-on obtenir ?
Réponses
Exercice VI:
Le bleu de Prusse est un pigment de formule Fe
4[Fe(CN)
6]
3
. On peut
l'obtenir par précipitation des ions Fe
3+ avec les ions
hexacyanoferrate(II) de formule Fe(CN)
64- .
1- Ecrire et équilibrer l'équation de cette précipitation
2- A l'aide d'un tableau d'avancement , déterminer les quantités de
matière d'ions Fe
3+ et d'ions hexacyanoferrate(II) qui
permettront
d'obtenir 5 g de pigment .
3- Pour réaliser l'expérience , on utilise une solution S
1
pour
laquelle [Fe
3+] = 2.10
-1 mol.L
-1 et
une
solution S
2 pour laquelle
[Fe(CN)
64-] = 1,5.10
-1 mol.L
-1
. Déterminer les volumes nécessaires de
S
1 et S
2 pour la synthèse de 5g de pigment .
Exercice VII :
On réalise le dosage de la vitamine C contenue dans un comprimé 500 mg
. Ce dosage est effectué par du diiode I
2 . La réaction
support du
dosage est : C
6H
8O
6 + I
2 = C
6H
6O
6
+ 2I
-
La concentration de la solution titrante est 1,0.10
-1 mol.L
-1
.
L'équivalence est obtenue pour Véq = 28,5 mL .
1- Faire un schéma du dosage .
2- Vérifier grâce à un tableau d'avancement que la quantité de vitamine
C dans le comprimé est proche de 0,5 g .
Exercice
VIII :
L'iodure de plomb de couleur jaune est
un pigment de couleur jaune qui a longtemps été utiliser pour les
peintures . On peut le synthétiser par réaction de précipitation entre
le nitrate de plomb et l'iodure de potassium .
L'équation complète s'écrit :
(Pb
2+ + 2NO
3-) + 2(K
++I
-)
= PbI
2(s) + 2(K
++NO
3-)
1- Ecrire l'équation simplifiée (sans les ions spectateurs)
2- Déterminer le volume de nitrate de plomb de concentration 10
-1
mol.L
-1 qu'il faudra pour réagir avec 50 mL d'une solution
contenant 1g
d'iodure de potassium .
3- Quelle masse d'iodure de Pb obtient-on alors ?